Twitter
Twitter
2019 -2024
Wir haben die Europäische Union auf Klimakurs gebracht. Mit dem Verbrenner-Aus, den Ausbauzielen für Erneuerbare Energien und Millionen für Klimainvestitionen tut die EU so viel für den Klimaschutz und die Zukunftssicherheit Europas wie nie zuvor. Wir sind eine treibende Kraft im Einsatz für Rechtsstaatlichkeit und Demokratie. Jahrelang haben wir uns dafür eingesetzt, dass die EU Autokraten wie Viktor Orban nicht einfach gewähren lässt. Jetzt zeigt die EU erstmals klare Kante, und wir Grüne im Europaparlament haben maßgeblich daran mitgewirkt. Wir haben Europas Außenpolitik grüner und sicherer gemacht und dazu beigetragen, die Übermacht von Google und Co zu zähmen. Wir setzen uns für eine grüne Industriepolitik ein, die international wettbewerbsfähig ist, und für ein Europa, das seinen Bürger*innen auch in Krisenzeiten sozialen Schutz und Zusammenhalt bietet.
Unser Engagement in Europa bringt handfeste Verbesserungen für die Menschen. Unsere Erfolge machen das Leben in Europa lebenswerter.
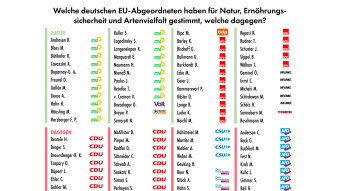
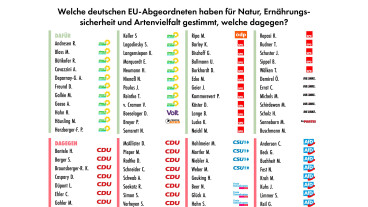
Was wurde konkret vom Europäischen Parlament beschlossen?